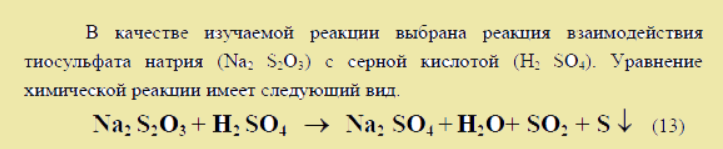- 05.04.2022 07:57
- Химия
- remove_red_eye 1281
- thumb_up 5
Ответы и объяснения 1
Ответ:
Правило нахождения и образец реакции ниже:
При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для реакции aA + bB → mM + nN математическое выражение закона действующих масс имеет вид:
v = k · CAa · CBb,
где v - скорость реакции; k - коэффициент пропорциональности, называемый константой скорости химической реакции (при CA = CB = 1 моль/л k численно равна v); CA и CB - концентрации реагентов A и B; a и b - стехиометрические коэффициенты в уравнении реакции.
Константа скорости химической реакции k определяется природой реагирующих веществ и зависит от температуры, от присутствия катализатора, но не зависит от концентрации веществ, участвующих в реакции.
Закон действующих масс справедлив только для наиболее простых по своему механизму взаимодействий, протекающих в газах или в разбавленных растворах.
Часто уравнение реакции не отражает ее механизма. Сложные реакции могут быть совокупностью параллельно или последовательно протекающих процессов. Закон действующих масс справедлив для каждой отдельной стадии реакции, но не для всего взаимодействия в целом. Та стадия скорость которой минимальна, лимитирует скорость реакции в общем. Поэтому математическое выражение закона действующих масс, записанное для самой медленной (лимитирующей) стадии процесса, приложимо одновременно ко всей реакции в целом.
Примеры решения задач:
Задача 1. Во сколько раз изменится скорость прямой и обратной реакций в системе 2SO2(г) + O2 = 2SO3(г) , если объем газовой смеси уменьшить в 3 раза? В какую сторону сместится равновесие системы?
Решение. Обозначим концентрации реагирующих веществ CSO2 = a, CO2 = b, CSO3 = d. Согласно закону действующих масс, скорости прямой и обратной реакций до изменения объема:
vпрямая = k1 · a2 · b ;
vобратная = k2 · d2 .
После уменьшения объема гомогенной системы в 3 раза концентрация каждого из реагирующих веществ увеличится в 3 раза: CSO2 = 3a, CO2 = 3b, CSO3 = 3d. При новых концентрациях скорости прямой и обратной реакций:
v'прямая = k1 · (3a)2 · 3b = 27 · k1 · a2 · b;
v'обратная = k2 · (3d)2 = 9 · k2 · d2.
Изменения скоростей составят:
v'прямая / vпрямая = 27
v'обратная / vобратная = 9
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной - в 9 раз. Равновесие системы сместилось в сторону образования SO3.
Похожее решение по ссылке ниже:
https://online-otvet.ru/himia/5b7496a0f047055642083a11
- 05.04.2022 08:47
- thumb_up 0
Знаете ответ? Поделитесь им!
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи - смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.